19. yüzyılın ilk yılları, kimyada maddeye bilimsel bakışı kökten değiştiren büyük gelişmelere tanık oldu. 1803’te John Dalton her elementin, o elemente özgü atomlardan oluştuğunu öne sürdü ve atom ağırlığı kavramını kullanarak, elementlerin birbirleriyle her zaman tam sayılı oranlarda nasıl birleştiklerini açıkladı.
Jöns Jakob Berzelius bu 2000 bileşiği inceleyip bu oranları araştırdı. Bugün kullandığımız adlandırma sistemini – hidrojen için H, karbon için C gibi – icat etti ve o zaman bilinen 40 elementin atom ağırlıklarının bir listesini hazırladı. Canlı organizmaların kimyası için “organik kimya” terimini – bu terim daha sonra karbon kimyası anlamına gelecekti – icat etti. 1809’da Fransız kimyacı Joseph Louis Gay-Lussac gazların basit oranlarda nasıl birleştiklerini açıkladı ve iki yıl sonra Italyan Amedeo Avogadro eşit hacimli gazların eşit sayıda molekül içerdiğini öne sürdü. Elementlerin bileşimini düzenleyen katı kurallar bulunduğu açıktı. Atomlar ve moleküller esas olarak kimsenin doğrudan görmediği teorik kavramlar olarak kaldı; ama açıklayıcılıkları giderek artan kavramlardı.
Gecenin bir kısmını bu düşüncelerin hiç olmazsa taslaklarını kağıda geçirmekle geçirdim. Yapısal teori bu şekilde var oldu.
Friedrich August Kekulé
Her elementin atomları diğer atomlarla belirli sayıda yolla birleşebilir. Buna valans denilir. Karbon atomlarının dörtlü bir valansı vardır. Benzen moleküllerinde, karbon atomları birbirine bağanıp halkalar oluşturur, hidrojen atomları onlara bağlanır. Bu yapı Kekulé’ye kendi kuyruğunu yakalayan bir yılan gibi görünür.
Valans
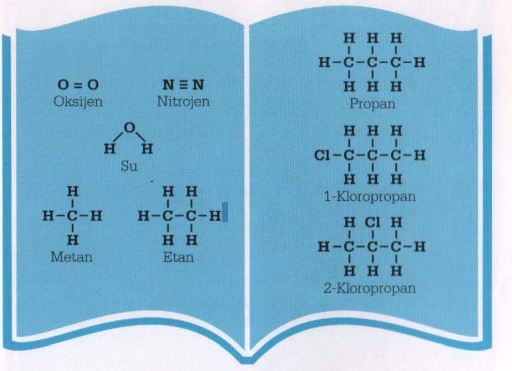
1852’de atomların birbirlerine nasıl bağlandığını anlamaya yönelik ilk adımı, valans – bir elementin her atomunun bağlanabileceği atom sayısı – düşüncesini tanıtan İngiliz kimyacı Edward Frankland attı. Hidrojenin bir valansı vardır, oksijenin iki. Sonra 1858’de Britanyalı kimyacı Archibald Scott Couper, kendi kendine bağlanan karbon atomları arasında bağlanan karbon atomları arasında bağlar oluştuğunu ve moleküllerin birbirine bağlanan atom zinciri olduklarını gösterdi. Dolayısıyla, iki parça hidrojen ile bir parça oksijenden oluştuğu bilinen su, H2O ya da H-O-H (burada “-” bir bağı gösterir) olarak ifade edilebilir. Karbonun dört valansı vardır, yani dört değerliklidir; bu yüzden bir karbon atomu, metan (CH4) olduğu gibi, dört bağ oluşturabilir; metanda hidrojen atomları karbonun etrafında dört yüzlü biçimde dizilir. (Bugün kimyacılar bir bağın, iki atomun paylaştığı elektron çiftini temsil ettiğini; H, O ve C simgelerinin uygun atomun merkez kısmını temsil ettiğini düşünür.)
Couper o sırada Paris’te bir laboratuvarda çalışıyordu. Bu arada Almanya’da, Heidelberg’de Friedrich August Kekulé aynı düşünceyi öne sürüp, 1857’de karbonun dört valanslı olduğunu ve 1858’de karbon atomların birbirine bağlanabildiğini ilan etmişti. Couper’ın tebliğinin yayımlanması gecikmişti; dolayısıyla Kekulé kendi tebliğini ondan bir ay önce yayımladı ve kendi kendine bağlanan karbon atomları düşüncesinde öncelik onun oldu. Kekulé atomların arasındaki bağlara “ilginlik” (affinity) dedi ve 1859’da çıkan popüler kitabı Textbook of Organic Chemistry‘de düşüncelerini daha ayrıntılı bir biçimde açıkladı.
Karbon Bileşikleri
Kimyasal tepkimelerden elde edilen kanıtlara dayalı teorik modeller çıkaran Kekulé, dört valanslı karbon atomlarının birbirine bağlanıp, başka valanslı başka atomların (hidrojen, oksijen ve klor gibi)bağlanabildiği bir “karbon iskeleti” oluşturduğunu ilan etti. Aniden organik kimya anlam kazanmaya başladı ve kimyacılar, her tür moleküle yapısal formül tahsis etti.
Metan (CH4), etan (C2H6) ve propan (C3H8) gibi basit hidrokarbonlar artık karbon atomları zinciri olarak görülüyordu; bu zincirde boş valansları hidrojien atomları doldurmaktaydı. Böyle bir bileşiğin, sözün gelişi klorla (Cl2) tepkimesi, bir ya da daha fazla hidrojen atomunun yerini klor atomunun aldığı bileşikler – klorometan ya da kloroetan gibi bileşikler – meydana getiriyordu. Bu yer değiştirmenin bir özelliği, klorun orta karbon atomuna mı yoksa uçtaki karbon atomlarından birine mi bağlandığına bağlı olarak kloropropanın iki farklı biçimde, 1-kloropropan ya da 2-kloropropan şeklinde olmasıydı. Bazı bileşiklerin, atom valanslarını doyurmak için çiftbağa ihtiyacı vardır: örneğin oksijen molekülü (O2) ve etilen molekülü (C2H4). Etilen klorla tepkimeye girer ve sonuç, yer değiştirme değil, katılma olur. Klor çift bağa eklenip 1,2 dikloroetan (C2H4Cl2) meydana getirir. Oldukça tepkin olan ve oksiasetilen kaynak hamlacında kullanılan asetilen (C2H2) ve nitrojen molekülü (N2) de dahil, bazı bileşiklerin üçlü bağı bile vardır.
Ama benzen bir bilmece olarak kaldı. Formülünün C6H6 olduğu anlaşıldı; ama asetilenle eşit sayıda karbon ve hidrojen atomlarına sahip olmasına rağmen, asetilenden çok daha az tepkindir. Yüksek tepkinli olmayan doğrusal bir yapı geliştirmek, gerçek bir muammaydı. Açıkçası çift bağ olmalıydı, ama nasıl dizildikleri bir sırdı. Dahası, benzen klorla katılarak (etilen gibi) değil, yer değiştirerek tepkimeye girer: Bir klor atomu bir hidrojen atomunun yerini alır. Benzenin hidrojen atomlarından birinin yerini bir klor atomu alınca, sonuç yalnızca tek bileşik olur: C6H5Cl, klorobenzen. Öyle görünüyordu ki, klor atomu herhangi bir karbon atomuna bağlandığına göre bütün karbon atomları eşdeğerdi.
Benzen Halkaları
Benzenin yapısına ilişkin bilmecenin çözümü, 1865’te bir rüyada Kekulé’ye malum oldu. Çözüm, karbon atomlarının oluşturduğu bir halkaydı; her birine bir hidrojen atomunun bağlandığı altı atomun hepsinin eşit olduğu bir halka. Yani klorobenzende klor, halkanın etrafında herhangi bir yere bağlanabilirdi.
Bu teoriye bir destek de, klorun hidrojenin yerini iki kez alıp diklorobenzeni (C6H4Cl) meydana getirmesiyle geldi. Eğer benzen, bütün karbon atomları eşit altı üyeli bir halkaysa, bu bileşiğin üç ayrı biçimi ya da “izomeri” olmalıdır – iki klor atomu bitişik karbon atomları üzerinde, başka bir karbonla ayrılmış karbon atomları üzerinde ya da halkanın karşıt uçlarında olabilirdi. İşin böyle olduğu anlaşıldı ve üç izomere sırasıyla orta-, meta- ve para- diklorobenzen adı verildi.

Bir hexabenzocoronene molekülünün bu görüntüsü, bir atomsal kuvvet mikroskopu kullanılarak elde edildi. Çapı 1,4 nanometredir ve farklı uzunlukta karbon-karbon bağlarını gösterir.
Simetri Kurmak
Benzen halkasının gözlemlenen simetrisi konusunda hala çözülmemiş bir sır vardı. Her karbon atomu dört valansını doyurmak için, diğer atomlarla dört bağı olmalıdır. Yani, hepsinin “yedek” bir bağı vardı. Kekulé ilk önce, halkanın etrafındaki almaşık tek ve çift bağları çizdi; ama halkanın simetrik olması gerektiği anlaşılınca, molekülün iki yapı arasında kararsız kaldığını öne sürdü.
Elektron 1896’ya kadar keşfedilmedi. Bağların elektron paylaşımıyla oluştuğu düşüncesini, Amerikalı kimyacı G. N. Wilson 1916’da önerdi. 1930’larda Linus Pauling kuantum mekaniğini kullanarak, benzen halkasındaki altı yedek elektronun çift bağlara yerleşmediğini, halkanın etrafına yayıldığını ve karbon atomları arasında eşit paylaşıldığını, bu nedenle karbon-karbon bağların tek ya da çift değil, 1,5 olduğunu açıkladı. Benzen molekülünün yapısına ilişkin bilmeceyi çözmek için fiziğin bu yeni düşüncelerine ihtiyaç vardı.
Esin Rüyası
Kekulé’nin rüyasını anlatımı, esin kıvılcımına ilişkin en çok anılan kişisel anlatımdır. Anlaşılan hipnogojik bir durumdaydı – uykuya dalmanın eşiğinde: Bu durumda gerçekler ile imgelem iç içe geçer. Bunu Halbschlaf, yani yarı-uyku olarak tarif etti. Aslında bu türden iki ayakta uyumayı tarif eder: İlki, olasılıkla 1855’te Güney Londra’da Clapham Road’a doğru giden bir otobüsün tepesinde. “Atomlar gözlerimin önünde kıpırdıyorlardı. Bu küçük parçacıkları hareket halinde hep görmüştüm, ama hareket tarzlarını anlamayı başaramamıştım. Bugün iki küçük atomun ne kadar sık kaynaşıp bir çift oluşturduğunu, büyüklerin küçükleri nasıl yuttuğunu ve daha büyüklerin üç, hatta dört küçük atomu bağladığını gördüm.”
İkinci olay Belçika’da, Ghent’teki çalışma odasında gerçekleşti; olasılıkla kendi kuyruğunu ısıran yılan simgesinden esinlendi: “Benzen halkası teorisinde de aynı şey oldu… Sandalyeyi şömineye çevirdim ve baygın bir durumdaydım… atomlar gözlerimin önünde kıpırdıyordu… Uzun sıralar, çoğu zaman daha yoğun bağlantılı; her şey hareket halinde, yılan gibi kıvrılıyor ve dönüyor. O da ne? Yılanlardan biri kendi kuyruğunu yakaladı ve bu görüntü gözlerimin önünde alay edercesine dönüp durdu.”

Kekulé benzen halkaları teorisini formüle ettiği anı rüya benzeri bir görüm olarak tarif etti; burada bir ejderha olarak tasvir edilen eski ouroboros simgesinde olduğu gibi kendi kuyruğunu ısıran bir yılan gördü.
Friedrich August Kekulé Kimdir?
Kendisine August diyen Friedrich August Kekulé, şimdi Almanya’nın Hesse eyaletinde bulunan Darmstadt’ta 7 Eylül 1829’da doğdu. Giessen Üniversitesindeyken mimarlık okumayı bırakıp, Justus von Liebig’in derslerini dinledikten sonra kimyaya yöneldi. Sonunda Bonn Üniversitesinde kimya profesörü oldu.
1057’de ve ertesi yıl Kekulé, karbonun dört valansı, basit organik moleküllerde bağlanma ve benzenin yapısı üzerine bir dizi yazı yayımladı; bu yayınlar onu, moleküler yapı teorisinin baş mimarı yaptı. 1895’te Kaiser II. Wilhelm tarafından soyluluk unvanı verildi ve August Kekulé von Stradonitz oldu. Kimya dalında ilk beş Nobel ödülünün üçünü onun öğrencileri aldı.
Önemli Eserleri:
1859 – Textbook of Organic Chemistry
1887 – The Chemistry of Benzene Derivatives or Aromatic Substances
