
18. yüzyılın sonuna doğru bilim insanları dünyanın bir dizi temel maddeden ya da kimyasal elementten oluştuğunu anlamaya başlamıştı. Ama hiç kimse bir elementin ne olduğundan emin değildi. İngiliz meteorolog John Dalton hava durumuna ilişkin incelemelerinde, her elementin kendine özgü benzersiz, özdeş atomlardan oluştuğunu ve bir elementi ayırt eden ve tanımlayan şeyin bu özel atom olduğunu gördü. Dalton kimyanın temelini attı. Atom düşüncesinin tarihi eski Yunanistan’a kadar geri gider; ama hep bütün atomların özdeş oldukları varsayılmıştı. Dalton’ın farkı, her elementin farklı atomlardan oluştuğunu anlamış olmasıydı. O zaman bilinen elementleri – hidrojen, oksijen ve nitrojen dahil – oluşturan atomları “katı, tek parça halinde, sert, içine girilmez, hareketli parçacıklar” olarak tarif etti.
– Elementler birbirleriyle birleşip sabit oranlı bileşikler oluşturur.
– Bu sabit oranlar her bir elementin atomlarının göreli ağırlığına bağlı olmalıdır.
– Bu nedenle bir elementin atom ağırlığı, bir bileşiğe giren her elementin ağırlığından hesaplanabilir.
– Elementler tablosu nihai parçacıkların ağırlığını temel alır.
Dalton’ın düşünceleri, havanın su emme miktarını hava basıncının nasıl belirlediğini araştırırken ortaya çıktı. Havanın farklı gazların bir karışımı olduğuna inanmaya başladı. Deney yaparken, verili miktarda saf oksijenin aynı miktarda saf nitrojenden daha az su buharı tuttuğunu gözlemledi ve bundan, oksijen atomlarının nitrojen atomlarından daha büyük ve daha ağır olduğu sonucunu çıkardı.
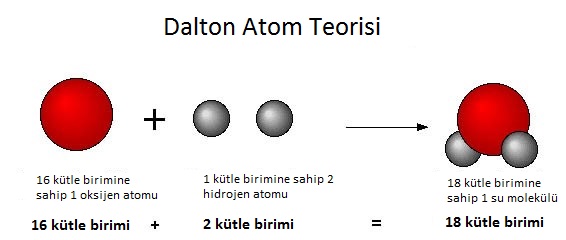
Ağırlık Önemlidir
Dalton farklı elementlerin atomlarının ağırlıklarına göre ayırt edilebileceğini anladı. İki ya da daha fazla elementin atomlarının ya da “nihai parçacıklarının” birleşip çok basit oranlı bileşikler oluşturduklarını gördü ve bu şekilde, bir bileşiğe giren her elementin ağırlığıyla her atomun ağırlığını çıkarabilirdi. Çok hızlı bir biçimde o zaman bilinen her elementin atom ağırlığını ortaya çıkardı.
Dalton’a göre hidrojen en hafif gazdı, bu nedenle onun atom ağırlığını 1 olarak belirledi. Suda hidrojenle birleşen oksijenin ağırlığından ötürü, oksijenin atom ağırlığını 7 olarak belirledi. Ne var ki, Dalton’un yönteminde bir kusur vardı; çünkü aynı elementin atomlarının birleşebileceğini fark etmedi. Bir atom bileşiğinde – bir molekülde – her elementten yalnızca bir atom olduğunu varsaydı. Ama Dalton’un çalışması bilim insanlarını doğru yola sokmuştu ve on yıl içinde İtalyan fizikçi Amedeo Avogadro bir moleküler oran sistemi geliştirip, atom ağırlıklarını doğru bir biçimde hesapladı. Yine de Dalton’un teorisinin temel düşüncesinin – her elementin kendine özgür benzersiz büyüklükte atomları olduğu düşüncesi – doğru olduğu anlaşıldı.
Dalton’nun tablosu farklı elementlerin simgelerini ve atom ağırlıklarını gösterir. Dalton, meteoroloji üzerinden, hava ve su parçacıklarının neden birbirine karışabildiğini kendine sorarak atom teorisine ulaştı.
John Dalton Kimdir?
İngiltere’de Lake District’te 1766’da Quaker bir ailede doğan John Dalton, 15 yaşından itibaren düzenli hava durumu gözlemleri yaptı. Bunlar birçok önemli içgörü edinmesini sağladı (atmosfer neminin hava soğuyunca yağmura dönüştüğünü görmesi gibi). Dalton meteorolojik araştırmaları dışında, kardeşiyle paylaştıkları bir durumdan da büyülendi: renk körlüğü. Bu konuyla ilgili bilimsel tebliği, 1817’de başkanlığına seçildiği Manchester Edebiyat ve Felsefe Derneğine kabul edilmesini sağladı. Bu dernek için, atom teorisiyle ilgili olanlar da dahil yüzlerce bilimsel yazı yazdı. Atom teorisi hızla kabul gördü ve Dalton sağlığında bir şöhret oldu. 1844’te Manchester’da cenaze törenine 40.000’den fazla kişi katıldı.

Önemli Eserleri:
1805 – Experimental Enquiry into the Proportion of the Several Gases or Elastic Fluids, Constituting the Atmosphere (Atmosferi Oluşturan Çeşitli Gazların ya da Elastik Sıvıların Oranları Üzerine Deneysel İnceleme)
1808 – 1827 – New System of Chemical Philosophy (Yeni Kimya Felsefesi Sistemi)

Elementler Hakkında Tarihsel Gelişmeler
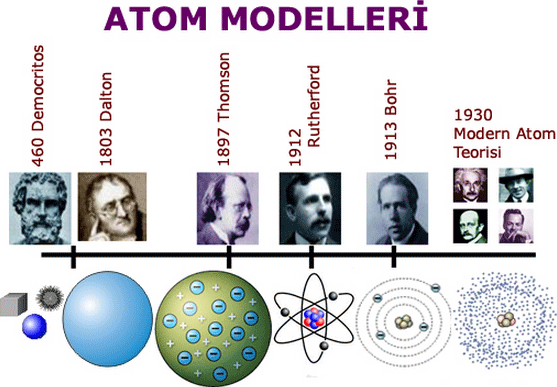
MS yaklaşık 400 – Demokritos, dünyanın bölünmez parçacıklardan oluştuğunu öne sürer.
MS 8. yüzyıl – İranlı bilgin Cabir bin Hayyan elementleri metal olanlar ve olmayanlar şeklinde sınıflandırır.
1794 – Joseph Proust; bileşiklerin, her zaman aynı oranda birleşen elementlerden oluştuğunu gösterir.
1811 – Amedeo Avogadro, eşit miktarda farklı gazın eşit sayıda molekül içerdiğini gösterir.
1869 – Dimitri Mendeleyev, elementleri atom ağırlıklarına göre sergileyen bir periyodik tablo çizer.
1897 – Joseph John Thomson elektronu keşfederek, olası en küçük parçacığın atom olmadığını gösterir.
